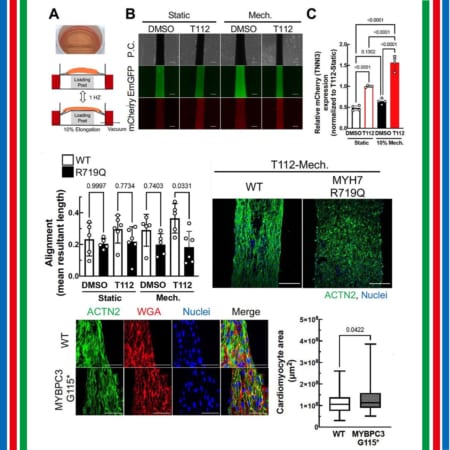
【米国】ムコ多糖症II型治療薬RGX-121承認得られず、FDAより審査完了報告通知を受領
日本新薬株式会社は2月10日、ムコ多糖症II型を期待適応症とする「RGX-121」について、提携先である米REGENXBIO社が米国食品医薬局(FDA)から審査完了報告通知(CRL)を受領したと発表しました。
CRLとは、FDAが承認申請の審査が完了した時点で、現在の申請内容では承認を出せないと判断した場合に発行する通知書のことです。REGENXBIO社は、CRLの内容を精査し、FDAと協議しながら、米国における次のステップを決定する予定としています。
ムコ多糖症II型は、イズロン酸スルファターゼという酵素の欠損により発症し、特徴的な顔貌、関節拘縮、肝脾腫、心弁膜症、中耳炎、発語の遅れ(重症型)などを特徴とする疾患です。
RGX-121は、日本新薬が2025年1月にREGENXBIO社から米国における独占的販売権、および日本を含むアジアにおける独占的開発販売権を取得している薬剤です。米国での販売に向けた準備は、NS Pharma社が引き続き担う予定となっています。