遺伝性脳⼩⾎管病CADASILの原因とみられる変異型タンパク質蓄積の機構解明、有効な治療法の確⽴に期待
千葉⼤学らの研究チームは10月17日、遺伝性脳⼩⾎管病であるCADASIL(指定難病124)の原因として知られるNOTCH3変異型タンパク質の蓄積に、糖鎖修飾酵素Radical fringe(RFNG)が寄与することを世界で初めて発⾒したと発表しました。
認知症の病態進⾏には⽼化などの環境要因に加え、遺伝的な要因も影響します。国内で、遺伝性の脳卒中によって引き起こされる認知症の半分以上は、CADASILと言われています。CADASILは、⽪質下梗塞と⽩質脳症を伴う常染⾊体優性脳動脈症の英語略称です。脳の⼩さな⾎管が障害されることで脳卒中(脳梗塞と脳出⾎)を繰り返し、認知症を発症します。CADASILは無症状期間を経た後、老化が遺伝的要因と組み合わせることで発症します。現在、病態解明はされておらず、根本的な治療法もありません。
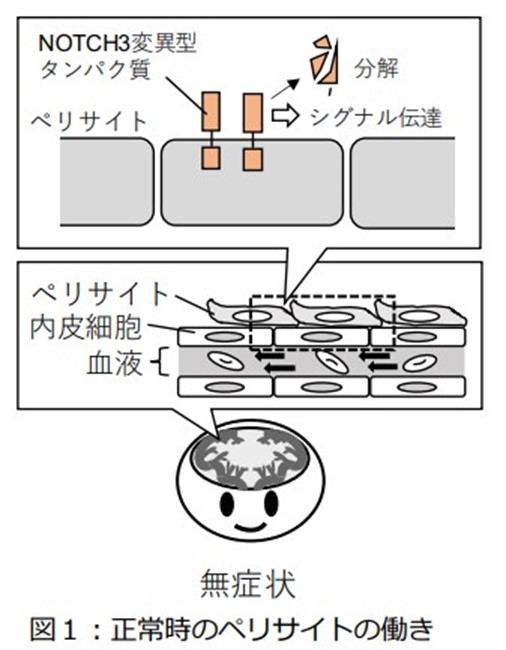
CADASILでは、脳の⼩さな⾎管が障害されます。⼩さな⾎管は「ペリサイト」と呼ばれる細胞によって⾎流が調節されています。ペリサイトの⽣存を促す主なタンパク質として、NOTCH3タンパク質がありますが、このタンパク質を作る遺伝⼦に変異が⽣じて、「NOTCH3CADASIL変異型タンパク質」が作られることがあります。これは、ペリサイトが⽣存し続け、⾎流が適切に調節されるためのシグナルである「Notch シグナル」を弱めるだけでなく、⾎管の周囲に異常に蓄積することで毒性が発揮され、⽼化と結びつくことでCADASILを発症すると考えられています。しかし、NOTCH3 CADASIL変異型タンパク質が⽼化と結びつくことで、どのようにして機能が低下し、タンパク質の蓄積が増加するのかは不明でした。
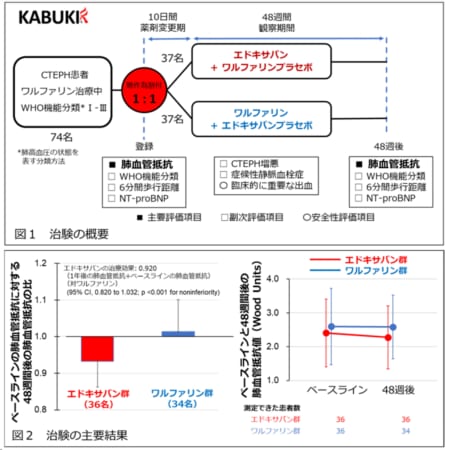
研究チームは、⽼化によってNOTCH3 CADASIL変異型タンパク質の糖鎖修飾が増えることで、Notchシグナルの低下とNOTCH3タンパク質の蓄積が起こると予測。CADASILで⾒られるNOTCH3遺伝⼦上に起こる変異のひとつであるC185R、R141C変異に着⽬して、糖鎖修飾の影響を検証しました。その結果、
①ペリサイトの⽼化によってRFNGの発現が上昇する
②RFNGは糖鎖修飾を促進する
③NOTCH3R141CとC185R変異型は正常なものに⽐べて、RFNGによって蓄積しやすい
④シグナル活性がRFNGによって著しく減弱する
といったメカニズムが明らかになりました。
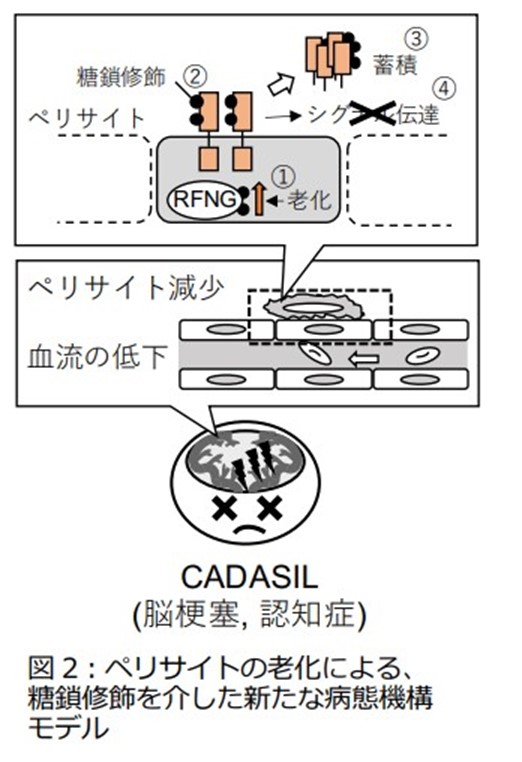
以上の研究成果より、RFNGが⽼化によって増えることで糖鎖修飾が促進し、NOTCH3 CADASIL変異型タンパク質であるC185RとR141C変異型がシグナル活性を弱め、さらに蓄積することで、その結果として⾎流が低下して脳梗塞や認知症を引き起こすという、糖鎖修飾を介した新たなCADASILの病態の機構が考えられました。同研究を発端として、NOTCH3の糖鎖修飾を介した病態の解明やCADASILの有効な治療法の確⽴が進むことが期待されます。
なお、同研究の成果は、「The Journal of Biological Chemistry」に9月18日付で公開されました。