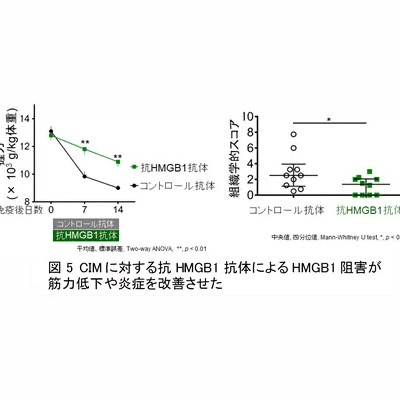
全身型重症筋無力症(gMG)と慢性炎症性脱髄性多発根神経炎(CIDP)に対するヒフデュラ配合皮下注シリンジ、製造販売承認を取得
アルジェニクスジャパン株式会社は9月19日、抗胎児性Fc受容体(FcRn)抗体フラグメント・ヒアルロン酸分解酵素配合製剤のプレフィルドシリンジ「ヒフデュラ配合皮下注シリンジ(エフガルチギモド アルファ(遺伝子組換え)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)皮下注射製剤)」について、全身型重症筋無力症(gMG)(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)と慢性炎症性脱髄性多発根神経炎(CIDP)を効能または効果として製造販売承認を取得したと発表しました。
全身型重症筋無力症(指定難病11、gMG)は、IgG自己抗体が神経と筋肉の間の伝達を妨害し、消耗性で生命を脅かす可能性のある筋力低下を引き起こす稀な慢性自己免疫疾患です。また、慢性炎症性脱髄性多発根神経炎(指定難病14、CIDP)は、末梢神経系の希少かつ重度な自己免疫疾患であり、IgG自己抗体による末梢神経の損傷が主病態であることが示唆されています。
ヒフデュラ配合皮下注シリンジは、エフガルチギモド アルファ(遺伝子組換え)とボルヒアルロニダーゼ アルファ(遺伝子組換え)を含有したプレフィルドシリンジ製剤です。2024年4月に発売されたバイアル製剤の「ヒフデュラ配合皮下注」と比較して、患者さんの利便性が向上し、医療従事者および介護者の負担軽減が期待されます。
今回の承認取得は、健康成人を対象に実施された、プレフィルドシリンジ製剤とバイアル製剤の単回皮下投与における生物学的同等性を検討した海外第1相生物学的同等性試験の結果に基づいたものです。
アルジェニクスジャパン代表取締役社長の後藤太郎氏は、今回の承認取得について、「私たちは、患者さんの声にしっかりと耳を傾け、ともに歩んでいくことを原動力に日々活動しています。この度の承認取得により、gMGとCIDPの患者さんに新たな治療の選択肢をお届けできるようになり、とても嬉しく思っております。ヒフデュラ配合皮下注シリンジが患者さんの自己注射や医療従事者及び介護者による投与負担軽減にお役立ていただけることを期待しています。当社は引き続き、自己免疫疾患の患者さんに、革新的な治療薬を提供することに注力してまいります」と述べています。